Das dritte Mal ist Prof. Dr. Dr. h.c. Hans-Dieter Höltje zu Gast im Wirkstoffradio. Nach den Episoden WSR001 Was sind Wirkstoffe? und WSR023 Wie Moleküle miteinander reden sprechen Bernd und André diesmal mit ihm über das Periodensystem der Elemente.

Von den Anfängen im 19. Jahrhundert, zu der Zeit als lediglich 33 chemische Elemente bekannt waren, erzählt Herr Höltje die Anfänge zur systematischen Beschreibung der Elemente. Danach wird das Periodensystem Stück für Stück in seiner Logik erklärt bis hin zum letzten, bekannten Element, dem Oganesson. Anschließend geht es um die verschiedenen Eigenschaften der Elemente und welche man davon bereits aus dem Periodensystem ablesen kann. Der Begriff Metall wird thematisiert, es geht um die Hybridisierung von Orbitalen und schließlich auch um Lieblingselemente.
(Im Podcast gibt es Kapitelmarken, die den Zwischenüberschriften hier im Text entsprechen, so dass es einfacher ist, bestimmte Teile erneut zu hören. Nicht jede Kapitelmarke hat eine Zwischenüberschrift, manchmal fassen wir mehrere Kapitelmarken unter einer Überschrift zusammen.)
Was ist das Periodensystem?
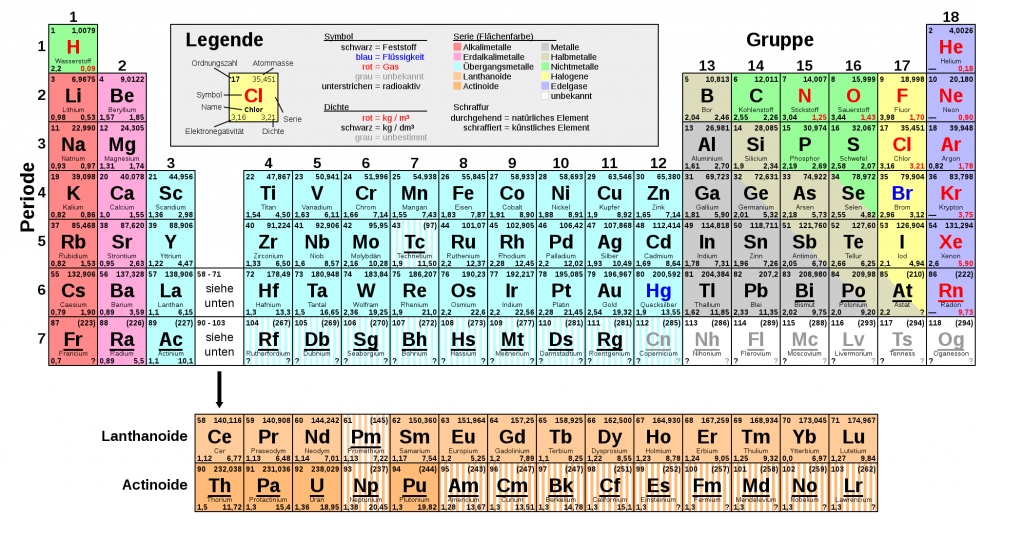
Herr Höltje erzählt, wie es überhaupt zu der Einordnung in ein System der chemischen Elemente kam. Anfang des 19. Jahrhunderts waren erst 33 chemische Elemente bekannt, wohingegen gegen Ende des 19. Jahrhunderts knapp 60 bekannt waren. Das Periodensystem wurde 1869 unabhängig voneinander und fast identisch von zwei Chemikern vorgestellt, zunächst von dem Russen Dmitri Mendelejew und wenige Monate später von dem Deutschen Lothar Meyer. Zur damaligen Zeit war es schon möglich, das Atomgewicht zu bestimmen, aber es waren kaum andere messbare Parameter der chemischen Elemente bekannt.
Diese Vorgehensweise von Mendelejew und Mayer führte aber zu Schwierigkeiten bei den Elementen Tellur und Jod.
Die Ordnungszahl
Diese Schwierigkeiten lösten sich auf durch die Verwendung der Ordnungszahl anstatt der Atommasse, die Henry Moseley 1914 vorschlug. Diese Veränderung konnte von Moseley nur vorgeschlagen werden, weil bereits mehr zum Atomaufbau bekannt war, vornehmlich durch die Arbeit von Ernest Rutherford. Die Ordnungszahl, oder auch Kernladungszahl, spielt auch eine wichtige Rolle im Moseleyschen Gesetz.
Von der Atomschale zum Atomorbital
Durch das Bohrsche Atommodell, erdacht vom dänischen Physiker Nils Bohr, konnte noch systematischer an die Gruppierung der chemischen Elemente heran gegangen werden. Den Arbeiten von Bohr liegt die Verbindung zwischen Spektrallinien mit bestimmten Energie-Niveaus von Elektronen in der Atomhülle zu Grunde. Um zum Konzept des Atomorbitals zu gelangen, benötigte es aber noch die Erkenntnisse aus der Quantenphysik. Es handelt sich bei den Atomorbitalen nämlich immer nur um Aufenthalts-wahrscheinlichkeiten.
Formen der Atomorbitale
Es gibt einige Formen bei den Atomorbitalen. Die einfachste Form, das s-Orbital, ist kugelsymmetrisch. Die nächst höheren p-Orbitale könnte man als Hanteln bezeichnen oder auch als zwei sich berührende Kugeln.

Obere Reihe: Darstellung der Wahrscheinlichkeitsdichten der Orbitale als Punktwolken.
Untere Reihe: Darstellung von Isoflächen. Die Isofläche ist jeweils so gewählt, dass sich das Elektron innerhalb des von der Isofläche umschlossenen Volumens mit 90 % Wahrscheinlichkeit aufhält. (gemeinfrei)
Systematischer Unterschied: Atommasse vs. Ordnungszahl
Die Ordnungszahl sagt etwas über die Atomkernladung aus und die Atommasse gibt das Gewicht eines Atoms an. Bei den leichten Elementen ergibt sich noch eine vergleichbare Reihenfolge der Elemente, bis zum Calcium mit der Ordnungszahl 20 und einer Atommasse von ca. 40. Allerdings steigt die Atommasse stärker als die Ordnungszahl an, da bei schwereren Atomen sich mehr ungeladene Neutronen im Kern befinden. Bereits beim Element Scandium mit der Ordnungszahl 21 beträgt die Atommasse knapp 45. Das geht weiter bis zum Blei, dem letzten stabilen Element, mit der Ordnungszahl 82 und einer Atommasse von 207. Elemente höherer Ordnungszahl sind noch schwerer, aber nicht mehr stabil d. h. sie zeigen radioaktiven Zerfall.
Die Neutronen sorgen überhaupt erst für die Stabilität im Atomkern – ohne Neutronen würden auch die stabilen Atomkerne zerfallen, weil die Abstoßungskräfte der vielen positiv geladenen Protonen im Kern zu groß wären.
Von allen Elementen gibt es Varianten, die sogenannten Isotope. Das heißt ein Element einer Ordnungszahl kann verschiedene Atommassen besitzen durch unterschiedlich viele Neutronen im Kern.
Gruppen und Perioden des Periodensystems der Elemente
Die Gruppen des Periodensystem sind die Spalten, die jeweils für sich genommen auch eigene Namen tragen, beispielsweise Halogene. Die Zeilen des Periodensystems bezeichnet man als Periode des Periodensystems, die nach der Hauptquantenzahl durchnummeriert sind.
Aufbau von Orbitalen und Hundsche Regeln
Links zu diesem Abschnitt:
-
- Quantenzahl, Wikipedia-Artikel
- Hundsche Regeln, Wikipedia-Artikel
- Pauli-Prinzip, Wikipedia-Artikel
- chemische Elemente der ersten Periode, Wikipedia-Artikel
2. Periode
-
- chemische Elemente der zweiten Periode, Wikipedia-Artikel
3. Periode
-
- chemische Elemente der dritten Periode, Wikipedia-Artikel
4. Periode
Ab der vierten Periode werden auch die d-Orbitale besetzt und die ersten Elemente der Nebengruppen kommen vor.
-
- chemische Elemente der vierten Periode, Wikipedia-Artikel
5. und 6. Periode
In der sechsten Periode kommt das Element Technetium vor, das erste Element, das künstlich hergestellt worden ist. In der sechsten Periode werden auch die f-Orbitale besetzt und die Gruppe der Lanthanoide kommt vor, die man auch seltene Erden nennt.
-
- chemische Elemente der fünften Periode, Wikipedia-Artikel
- chemische Elemente der sechsten Periode, Wikipedia-Artikel
7. Periode
Alle Elemente der siebten Periode sind radioaktiv, also nicht stabil. So wie die Lanthanoide in der sechsten Periode durch die Besetzung der f-Orbitale hinzu kommen, kommen in der siebten Periode die Actinoiden durch Besetzung der f-Orbitale dazu. Das letzte Element der siebten Periode ist das Organesson und auch das Element mit der höchsten Ordnungszahl 118. Zur Zeit wird nach den Elementen mit den Ordnungszahlen 119 und 120 gesucht, aber bisher ist man noch nicht fündig geworden.
-
- chemische Elemente der siebten Periode, Wikipedia-Artikel
- IUPAC (International Union of Pure and Applied Chemistry), Wikipedia-Artikel
- Magische Zahl oder Inseln der Stabilität, Wikipedia-Artikel
Das Periodensystem und die Gruppeneigenschaften
Links dazu:
Kohlenstoff
Der Kohlenstoff ist das Lieblingselement von Herrn Höltje. Es tritt als Diamant, Graphit und noch in vielen anderen Formen auf.
Das besondere ist beim Kohlenstoff die Hybridiserung von s- und p-Orbitalen zu den Hybridorbitalen. Das kugelförmige s-Orbital und die drei Hantelförmigen p-Orbitale werden gemischt und es entstehen vier sp3 Hybridorbitale oder, wenn ein p-Orbital außen vor bleibt, drei sp2 Hybridorbitale.
Damit es zur Hybridisierung kommt, müssen die Hybridorbitale energetisch günstiger sein.
Außerdem wird die besondere Form des Ruß angesprochen, die keine Hybridkonfiguration hat.
Bindungen, Moleküle und Elektronegativität
Am Periodensystem kann man auch etwas über die Elektronegativität der Elemente ablesen. Die Elektronegativität nimmt von links nach rechts zu und von oben nach unten ab.
Welche Elemente sind lebenswichtig?
André macht ein kleines Experiment: Ob es im Gespräch möglich ist auszumachen welche Elemente für das Leben wichtig sind – und dabei kam raus, dass eigentlich alle Elemente irgendwie eine wichtige Rolle spielen. Mache nur eine kleine, manche eine … elementare. 😉
Prof. Dr. Höltjes Lieblingselement
Der Kohlenstoff, wie bereits oben besprochen.
Bernds Lieblingselement
Kalium. Und dazu erzählt Bernd eine kleine Geschichte.
André Lieblingselement
Wir bedanken uns ganz herzlich bei Prof. Dr. Hans-Dieter Höltje für das Gespräch, die Erklärungen und die vielen anschaulichen Vergleiche.
Wir freuen uns immer über Feedback: per Mail unter info@wirkstoffradio.de, in den Kommentaren unter den einzelnen Episoden, über Twitter @wirkstoffradio oder auch als Bewertung bei iTunes oder panoptikum.social.
Wirkstoffradio-Feedback-Telefon +49 (0)30 746 910 64
Wirkstoffradio ist lizenziert unter einer Creative Commons Namensnennung - Keine Bearbeitungen 4.0 International Lizenz.




Hi,
ich finde das Thema mit der stabilen Insel interessant. Ich glaube, die Ordnungszahl 114 sollte wohl das stabilste Isotop bilden.
Könnte es sein, dass es weitere stabile Inseln gibt? Könnte man so an neue stabile Elemente gelangen, die man als neuen Werkstoff (mit neuen besonderen Eigenschaften) verwenden könnte? Oder gibt es Limits, die es nicht möglich machen, ein Element zB. mit der Ordnungszahl 200 oder 300 herzustellen (mal abgesehen davon, dass es technisch aktuell nicht machbar ist)?
Danke und viele Grüße.
Hallo André,
Es wurden mehrere Ordnungszahlen diskutiert darunter auch die Ordnungszahl 114, aber bisher ist es nicht gelungen die Annahmen zu stabilen Isotopen superschwerer Elemente schwerer als 208 Blei zu bestätigen.
Alle Isotope künstlich erzeugter superschwerer Elemente sind instabil. Zu den Möglichkeiten in diesem Feld kann ich Dir leider wenig sagen, da diese weder als Werkstoff noch als Wirkstoff eine Rolle spielen.
Vielen Dank für Dein Interesse und viele Grüße
Bernd
Mit weitem Abstand war dies für mich zum einen die lehrreichste, aber auch interessanteste Folge des Wirkstoffradios. Gratulation an euren tollen Gast Prof. Höltje und die Auswahl desselben.
Ich bin zwar einer der Mitmacher des Proton-Podcast und das Periodensystem ist unser Kernthema, aber für mich sind eher die kulturhistorischen Aspekte relevant, beziehungsweise kann ich zu diesen etwas beitragen, während Chemie ganz und gar nicht mein Gebiet ist.
Ich habe vieles gelernt, oder, besser formuliert, neu und anders verstanden. Vielen Dank dafür.
Im zweiten Halbjahr starte ich endlich den Podcast „Podzension“ – der Podcast zu Rezension anderer Podcasts. Ihr kriegt auf jeden Fall eine Episode.
Vielen Dank.
Arvid
Lieber Arvid,
vielen Dank für Deinen netten Kommentar. Vor allem Prof. Höltje wird das sehr freuen, weil für Ihn diese Episode ein persönliches Anliegen war.
Das Periodensystem ist ein so vielschichtiges Thema, dass man immer wieder neue Aspekte entdeckt.
Viel Glück für Deinen neuen Podcast und wir sind schon gespannt auf deine Rezension.
Viele Grüße
Bernd