Bernd und André waren in Dortmund am ISAS, dem Leibniz-Institut für Analytische Wissenschaften in Dortmund und haben sich dort mit Dr. Erik Freier getroffen, um mit ihm über Enzyme, Wirkstoff-Herstellung und CARS-Mikroskopie zu sprechen.

Bernd hatte Dr. Freier auf den Wirkstofftagen 2018 bei einem Vortrag gesehen. Die Wirkstofftage sind ein jährliches Treffen des Leibniz-Forschungsverbundes „Wirkstoffe und Biotechnologie“, der diesen Podcast auch unterstützt. Bei den kommenden Wirkstofftagen 2019 werden Bernd und André dabei sein, wie schon in Folge WSR008 Die Statistik der HIV-Selbsttests und Wirkstoff Screening angekündigt. Jedenfalls war Bernd vom Vortrag von Dr. Freier begeistert und musste auch gleich an André denken, weil es auch um Mikroskopie ging.
Und mit der Frage nach der Mikroskopie beginnt das Gespräch dann auch. Dr. Freier erklärt, dass Wirkstoffe viel zu klein sind, um sie mit einem Lichtmikroskop beobachten zu können. Aber Wirkstoffforscher*innen interessiert auch die Umgebung und größere Strukturen, in denen Wirkstoffe hergestellt werden und dabei kann die Mikroskopie helfen. Zunächst gibt Dr. Freier einen Überblick, was mit einem Mikroskop überhaupt zu beobachten ist und was nicht. Dabei kommen einige Stichworte vor, hier eine Link-Liste dazu:
-
- Fluoreszenzmikroskopie (Wikipedia-Artikel)
- Fluoreszenz (Wikipedia-Artikel)
- Zelle (Wikipedia-Artikel)
- Zelltod (Wikipedia-Artikel)
- Organell (Wikipedia-Artikel)

Das Gebiet, mit dem sich Dr. Freier am ISAS vor allem beschäftigt, ist die CARS-Mikroskopie, eine Abkürzung für „coherent anti-Stokes Raman scattering“, die zur Klasse der nichtlinearen Raman-Spektroskopie gehört. Vom Aufbau her ist ein CARS-Mikroskop ein Laser-Scanning-Mikroskop, bei dem ein Laser die Probe Punkt für Punkt abtastet und das jeweilige Fluoreszenz-Signal der Probe aufzeichnet. Im Gegensatz zur Fluoreszenzmikroskopie, bei der mit Fluoreszenzfarbstoffen die Probe angefärbt wird und diese unter Umständen Prozesse in der Zelle stören können, verwendet CARS einen anderen Effekt: Die Vibrationsspektroskopie.
Jedes Molekül schwingt oder vibriert und zwar nach einem bestimmten Muster, welches für das jeweilige Molekül spezifisch ist. Man kann beispielsweise in einer Zelle jedes Molekül in seinen charakteristischen Vibrationszustand anregen und dann ein Vibrationsspektrum messen. Aus diesem Spektrum rekonstruiert man dann, welche Moleküle an diesem Spektrum beteiligt sind – dazu sind teilweise sehr aufwändige Analysen nötig. Ohne Bioinformatiker geht da nichts. Und da das CARS-Mikroskop, wie oben bereits erwähnt, ein Laser-Scanning-Mikroskop ist, kann man so auch ein Bild zusammensetzen. Also Punkt für Punkt ein Vibrationsspektrum messen, um daraus dann quasi eine Karte „Molekülvorkommen“ zu erstellen.

Um die Aufnahme der Vibrationsspektren richtig zu verstehen, muss man sich ein bisschen mit der Grundlage von allem beschäftigen, sagt Dr. Freier, und das ist die Raman-Spektroskopie. Dabei wird die Probe mit monochromatischem Licht, also Licht einer Wellenlänge, bestrahlt. Wenn dieses Licht einen Vibrationszustand anregt, kann man Licht mit ein wenig geringerer Energie detektieren, es wird etwas zum roten hin verschoben. Umgekehrt ist es auch möglich, dass durch das Licht ein Vibrationszustand Energie verliert und das Licht mit etwas mehr Energie zurück kommt, das Licht wird also etwas zum blauen hin verschoben. Zusammengefasst: Man bestrahlt die Probe mit Licht einer Farbe, bekommt mehrfarbiges Licht zurück, und diese Unterschiede sind die „Fingerabdrücke“ der einzelnen Moleküle. Man bezeichnet dies auch als inelastische Streuung, im Gegensatz zur elastischen Streuung bei der Licht keine Energie überträgt. Um aus diesem mehrfarbigen Licht Informationen über die Moleküle zu erhalten und daraus ein Bild zu errechnen, bedarf es genauer Kenntnis einer Vielzahl von „Molekülfingerabdrücken“ und dies ist nur durch entsprechende Software zu leisten. Das Problem der Raman-Spektroskopie ist allerdings die Messzeit: würde man diese Technik in einem Laser-Scanning-Mikroskop anwenden, müsste man pro Bildpunkt einige Sekunden messen.
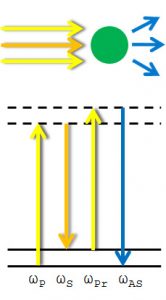
Der Trick bei CARS, im Gegensatz zur Raman-Spektroskopie, ist, dass man die Probe mit mehren Lasern (also mehreren Farben) gleichzeitig beleuchtet, mit dem Ziel, den Molekülen Energie für ihre jeweiligen Vibrationszustände zur Verfügung zu stellen. Dadurch wird der Fall der Blauverschiebung, die bereits bei der Raman-Spektroskopie erwähnt wurde, viel wahrscheinlicher. Man nennt diese Strahlung auch Anti-Stokes-Verschiebung. Dieses Vorgehen hat ein sehr viel günstigeres Signal-zu-Rausch-Verhältnis, da es nicht von anderen Effekten wie Fluoreszenz überlagert wird, und die Messung viel schneller geht. Außerdem sorgt dies dafür, dass das CARS-Signal gerichtet ist, man also nicht Photonen in jeder Raumrichtung detektieren muss, sondern lediglich einen Detektor hinter der Probe benötigt, was die Messung effizienter macht. Mit dem CARS-Mikroskop von Dr. Freier ist eine Auflösung von ca. 300 nm möglich. Link-Liste mit weiteren Begriffen:
-
- Kohärenz (Wikipedia-Artikel)
- Eigenschaften von Laserstrahlung (Wikipedia-Artikel)
- Auflösung (Mikroskopie) (Wikipedia-Artikel)
Dr. Freier erzählt dann, was er genau mit seiner CARS-Mikroskopie untersucht, besonders im Kontext eines besonderen Forschungsverbundes der Leibniz-Gemeinschaft. Er ist nämlich Teil des Leibniz Research Cluster – Bio/synthetische multifunktionale Mikroproduktionseinheiten – neuartige Wege der Wirkstoffentwicklung. In diesem Verbund liegt der Fokus von Dr. Freier besonders auf Enzymen, kleine Maschinen, die eine bestimmte Produktion oder Reaktion innerhalb einer Zelle durchführen. Vor allem ist es das Ziel dieses Leibniz Research Clusrers (LRC), mit Hilfe dieser Enzyme neue Wirkstoffe zu finden und herzustellen, und zwar ausschließlich mit den Enzymen, ohne den ganzen Reste der Zelle. Dieser „zellfreie“ Ansatz hat zwei Vorteile: zum einen ist auf diese Weise keinerlei genetisches Material am Prozess beteiligt, denn Enzyme sind nur große Proteine und tragen keine DNA. Zum anderen ist eine Zelle ein lebendes System, in dem viele Prozesse ablaufen und eine Reduktion auf nur einen Prozess, den ein Enzym durchführt, macht die ganze Geschichte kontrollierbarer und besser handhabbar. Außerdem können in einem solchen System höhere Konzentrationen aller möglichen Stoffe vorkommen, die für Zellen schon tödlich wären, und auch Stoffe produziert werden, die ganz gezielt gegen bestimmte Zellen wirken, Antibiotika beispielsweise.

Diese Enzyme werden in Mikroreaktoren eingebracht, in denen dann (später) potentielle Wirkstoffe hergestellt werden sollen. Mikroreaktoren sind kleine Labore in einem Format, ähnlich wie ein Mikrochip in der Computertechnik, nur basieren die Vorgänge dort auf biochemischen Prozessen und der Mikrofluidik. Weitere Stichworte hierzu:
-
- Bioreaktor (Wikipedia-Artikel)
- Immobilisierung (Wikipedia-Artikel)
- Proteinreinigung (Wikipedia-Artikel)

Es gibt dazu auch weitere Informationen auf der Homepage von Dr. Freier: Analytik für die Wirkstoffentwicklung.
André fragt, was es mit den vorher erwähnten „biologischen Ziegelsteinen“ oder Bioblicks auf sich hat. Damit sind die Enzyme gemeint, die in den Mikroreaktoren verwendet werden – da sie ja eigentlich „nur“ ein Baustein aus einer Zelle sind, und in den Mikroreaktoren in einem anderen Kontext verwendet werden. Die Wortschöpfung Biobrick ist nicht von Dr. Freier oder Kollegen aus dem LRC, diesen Begriff gibt es schon länger. Im LRC gibt es zwei Gruppen die sich sehr intensiv mit Biobricks beschäftigen:
Die Idee hinter den Biobricks ist, dass man von einfachen Enzymen, die nur ein paar Atome miteinander verbinden, langsam zu immer komplexeren Enzymen oder Biobricks kommt, die große Moleküle herstellen, so groß, wie es bisher mit enzymatischen Verfahren in technischen Anlagen bisher nicht möglich war. Dr. Freier erklärt das am Beispiel von Coenzym A.

Wir kommen zu einer anderen Mikroskopiemethode, der SERS-Mikroskopie. Das ist kurz für Surface Enhanced Raman Scattering, oder zu Deutsch: Oberflächenverstärkte Raman-Streuung. Dabei erzeugt man Oberflächen aus Gold oder Silber mit einer sehr hohen Rauheit im atomaren Bereich. Die kleinen Unregelmäßigkeiten auf der Oberfläche wirken dann wie Antennen, und Materialien in der Nähe einer solchen Antenne liefern ein weitaus höheres Raman-Signal. Der Vorteil gegenüber CARS ist hier, dass man einen Raman-Aufbau verwenden kann und auf die aufwändige Laser-Technik der CARS-Mikroskope verzichten kann. Der Nachteil ist allerdings, dass man kaum kontrollieren kann, wo diese verstärkenden Antennen auf der Oberfläche liegen. Diese sind punktförmig und recht zufällig verteilt – nicht die ganze Oberfläche sorgt für eine Verstärkung des Raman-Signals. Daher ist die SERS-Technik eigentlich ungeeignet für die Verwendung in Mikroreaktoren. Allerdings forscht die Gruppe von Dr. Freier daran, wie man gezielt einzelne Hot-Spots erzeugen kann, genau an den Stellen des Mikroreaktors, die interessant sind. In dem Fall würde man dann Ortsauflösung tauschen gegen Einfachheit der Technik, da man kein aufwändiges CARS-Mikroskop benötigt.
Bernd wirft ein, dass Dr. Freier und André noch ein paar Begriffe aus der Mikroskopie erklären sollten, was sie dann auch tun. Ein paar Links dazu:
-
- Konfokalmikroskop (Wikipedia-Artikel)
- Hellfeldmikroskopie (Wikipedia-Artikel)
- Lochblende (Wikipedia-Artikel)
Schließlich kommt das Thema der Geräte um die Mikroreaktoren, denn irgendwie müssen die Flüssigkeiten hinein und hinaus, aber vor allem möchte Dr. Freier natürlich die produzierten Stoffe heraus bekommen. Dafür wird eine Freifluss Elektrophorese (FFE) verwendet, beziehungsweise in Dr. Freiers Labor, weil dort alles sehr klein ist, Mikro-FFE.

Bei der FFE wird eine Spannung quer zum Flüssigkeitsstrom angelegt, durch die Moleküle spezifisch ihrer hydrodynamischen Größe und Ladung abgelenkt werden können, und so an den Seiten der FFE Kammer ausgeleitet werden (im obigen Bild durch die länglichen schwarzen Dichtungen gut zu erkennen). Dr. Freier geht noch weiter ins Detail bezüglich des Einsatzes in geschlossenen Kreisläufen zusammen mit Mikroreaktoren, und wie dieses System bei Coenzym A eingesetzt wird, das bereits bei den Biobricks zur Sprache kam.
Dr. Freier erklärt auch, wie bisher Wirkstoffe in Bioreaktoren hergestellt werden, wie der technische Aufwand und Aufbau ist, und welche Vor- und Nachteile es dabei gibt – um einen Vergleich zu dem Mikroreaktor Ansatz mit den Biobricks zu haben. Auch sprechen wir über die Skalierung des Mikroreaktor-Ansatzes und wie die Forschung in diesem kleinen Format Erkenntnisse für eine größere Produktion liefern kann.

André fragt nach dem Werdegang von Dr. Freier. Den Anfang macht das Studium der Physik, wo er sich dann größtenteils mit Halbleiterphysik beschäftigt hat. Aber recht bald kam dann auch die Grundlagenforschung an Proteinen hinzu. Mit seiner Doktorarbeit ist er immer mehr in den Biomedizinischen Bereich gewechselt – hat dort aber immer noch die physikalischen Methoden der Spektroskopie und Mikrospektroskopie angewandt. Zu diesem Zeitpunkt kam er dann auch mit der CARS-Mikroskopie in Kontakt, dies führte dazu , dass er am ISAS die Gelegenheit hatte eine Nachwuchsgruppe aufzubauen, die im Rahmen des Leibniz Research Clusters gegründet wurde.
Das LRC ist das erste seiner Art in der Leibniz-Gemeinschaft, und daher werden auch die Rahmenbedingungen dafür thematisiert. Gestartet wurde das ganze 2015 mit einer Laufzeit von 5 Jahren, gefördert durch die beteiligten Leibniz-Institute und das Bundesministerium für Bildung und Forschung (BMBF). Die Idee dahinter war, fünf Nachwuchsgruppen relativ ergebnisoffen an einem Bereich arbeiten zu lassen, um Möglichkeiten für neue Ideen und Ansätze zur Bewältigung der Fragestellung zu ermöglichen. Ein anderes Vorgehen im Vergleich zu vielen anderen Förderprogrammen.
Zum Abschluss wird über die Größe und Ausstattung von Dr. Freiers Nachwuchsgruppe gesprochen (Menschen, Geräte, Räume), und auch über verschiedene Möglichkeiten der Analytik. Ein paar spannende Einordnungen und Möglichkeiten zu Vergleichsmessungen werden hier noch besprochen.
Dr. Freiers Lieblingsmolekül/Liebingswirkstoff: Es fällt im schwer sich da festzulegen, aber er freut sich immer, wenn er über Stoffe stolpert, die exotische Bindungen haben. Exotisch in dem Sinne, dass diese Bindungen bei der CARS-Mikroskopie in Bereichen des Spektrums auftauchen, wo sonst eigentlich nichts zu finden ist – und er hat dazu auch gleich einen Vorschlag, dies in seiner Forschung anzuwenden.
Bitte ignoriert einfach Andrés Abschlusskommentar, bei dem er sich herzlich fürs „Zusehen“ bedankt – manchmal ist er etwas neben der Spur, wenn er über Mikroskope quatschen darf.
Wir freuen uns immer über Feedback: per Mail unter info@wirkstoffradio.de, in den Kommentaren unter den einzelnen Episoden, über Twitter @wirkstoffradio oder auch als Bewertung bei iTunes oder panoptikum.social.
Wirkstoffradio ist lizenziert unter einer Creative Commons Namensnennung - Keine Bearbeitungen 4.0 International Lizenz.